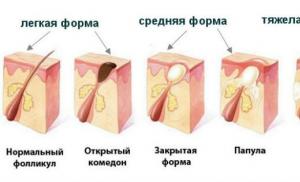
Что такое основные оксиды. Основные оксиды и их свойства
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор , который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO 2 , N 2 O 5 ,Na 2 O, SO 3 и т. д.)
- Несолеобразующие оксиды(CO, N 2 O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na 2 O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn 2 O 7 ,CO 2 , N 2 O 5 , SO 2 , SO 3 и т д)
- (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты
. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания
, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания
, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность
.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность
.
CO 2 – оксид углерода (IV)
N 2 O 3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н 2 О), так и газами (СО 2 , SO 3) или твёрдыми веществами (Al 2 O 3 , Fe 2 O 3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н 2 О, СО) и белой (ZnO, TiO 2) до зелёной (Cr 2 O 3) и даже чёрной (CuO).
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом:  При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований:
При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований: Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO 3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO 3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO 2 является основным компонентом стекла. Оксид хрома Cr 2 O 3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO 2 , который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Сегодня мы начинаем
знакомство с важнейшими классами неорганических соединений. Неорганические
вещества по составу делятся, как вы уже знаете, на простые и сложные.
|
ОКСИД |
КИСЛОТА |
ОСНОВАНИЕ |
СОЛЬ |
|
Э х О у |
Н n A А – кислотный остаток |
Ме(ОН) b ОН – гидроксильная группа |
Me n A b |
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
Оксиды
- это сложные вещества, состоящие из двух химических элементов, один из которых
кислород, с валентность равной 2. Лишь один химический элемент - фтор,
соединяясь с кислородом, образует не оксид, а фторид кислорода OF 2 .
Называются они просто - "оксид + название элемента" (см. таблицу). Если
валентность химического элемента переменная, то указывается римской цифрой,
заключённой в круглые скобки, после названия химического элемента.
|
Формула |
Название |
Формула |
Название |
|
оксид углерода (II) |
Fe 2 O 3 |
оксид железа (III) |
|
|
оксид азота (II) |
CrO 3 |
оксид хрома (VI) |
|
|
Al 2 O 3 |
оксид алюминия |
оксид цинка |
|
|
N 2 O 5 |
оксид азота (V) |
Mn 2 O 7 |
оксид марганца (VII) |
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
|
Оксиды металлов Ме х О у |
Оксиды неметаллов неМе х О у |
|||
|
Основные |
Кислотные |
Амфотерные |
Кислотные |
Безразличные |
|
I, II Ме |
V-VII Me |
ZnO,BeO,Al 2 O 3 , Fe 2 O 3 , Cr 2 O 3 |
> II неМе |
I, II неМе CO, NO, N 2 O |
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):

2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO 3 -оксид хрома (VI), Mn 2 O 7 - оксид марганца (VII)):

3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III , иногда IV , а также цинк и бериллий (Например, BeO , ZnO , Al 2 O 3 , Cr 2 O 3 ).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O , NO , CO ).
Вывод:характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO ( II - основный);
Cr 2 O 3 ( III - амфотерный);
CrO 3 ( VII - кислотный).
Классификация оксидов
(по растворимости в воде)
|
Кислотные оксиды |
Основные оксиды |
Амфотерные оксиды |
|
Растворимы в воде. Исключение – SiO 2 (не растворим в воде) |
В воде растворяются только оксиды щелочных и щелочноземельных металлов (это металлы I «А» и II «А» групп, исключение Be , Mg ) |
С водой не взаимодействуют. В воде не растворимы |
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl 3 , K 2 O, H 2 SO 4 , SO 3 , P 2 O 5 , HNO 3 , CaO, CO.
2.
Даны
вещества
: CaO, NaOH, CO 2 , H 2 SO 3 , CaCl 2 , FeCl 3 , Zn(OH) 2 , N 2 O 5 , Al 2 O 3 , Ca(OH) 2 , CO 2 , N 2 O, FeO
,
SO 3 , Na 2 SO 4 , ZnO, CaCO 3 , Mn 2 O 7 , CuO, KOH, CO, Fe(OH) 3
Получение оксидов
Тренажёр "Взаимодействие кислорода с простыми веществами"
|
1. Горение веществ (Окисление кислородом) |
а) простых веществ Тренажёр |
2Mg +O 2 =2MgO |
|
б) сложных веществ |
2H 2 S+3O 2 =2H 2 O+2SO 2 |
|
|
2.Разложение сложных веществ (используйте таблицу кислот, см. приложения) |
а) солей СОЛЬ t = ОСНОВНЫЙ ОКСИД+КИСЛОТНЫЙ ОКСИД |
СaCO 3 =CaO+CO 2 |
|
б) Нерастворимых оснований Ме(ОН) b t = Me x O y + H 2 O |
Cu (OH) 2 t =CuO+H 2 O |
|
|
в) кислородсодержащих кислот Н n A = КИСЛОТНЫЙ ОКСИД + H 2 O |
H 2 SO 3 =H 2 O+SO 2 |
Физические свойства оксидов
При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe 2 O 3 и др.), некоторые - жидкости (Н 2 О, Сl 2 О 7 и др.) и газы (NO, SO 2 и др.).



Химические свойства оксидов
|
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 1. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO 2 = CaSO 3 2. Основной оксид + Кислота = Соль + Н 2 О (р. обмена) 3 K 2 O + 2 H 3 PO 4 = 2 K 3 PO 4 + 3 H 2 O 3. Основной оксид + Вода = Щёлочь (р. соединения) Na 2 O + H 2 O = 2 NaOH |
|
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид + Вода = Кислота (р. соединения) С O 2 + H 2 O = H 2 CO 3 , SiO 2 – не реагирует 2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена) P 2 O 5 + 6 KOH = 2 K 3 PO 4 + 3 H 2 O 3. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO 2 = CaSO 3 4. Менее летучие вытесняют более летучие из их солей CaCO 3 + SiO 2 = CaSiO 3 + CO 2 |
|
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ Взаимодействуют как с кислотами, так и со щелочами. ZnO + 2 HCl = ZnCl 2 + H 2 O ZnO + 2 NaOH + H 2 O = Na 2 [ Zn (OH ) 4 ] (в растворе) ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении) |
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
SO 3 + H 2 O = H 2 SO 4
CaO + H 2 O = Ca ( OH ) 2
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.
Задания для закрепления
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl 3 , K 2 O, H 2 SO 4 , SO 3 , P 2 O 5 , HNO 3 , CaO, CO.
2. Даны вещества : CaO, NaOH, CO 2 , H 2 SO 3 , CaCl 2 , FeCl 3 , Zn(OH) 2 , N 2 O 5 , Al 2 O 3 , Ca(OH) 2 , CO 2 , N 2 O, FeO , SO 3 , Na 2 SO 4 , ZnO, CaCO 3 , Mn 2 O 7 , CuO, KOH, CO, Fe(OH) 3
Выберите из перечня: основные оксиды, кислотные оксиды, безразличные оксиды, амфотерные оксиды и дайте им названия .
3. Закончите УХР, укажите тип реакции, назовите продукты реакции
Na 2 O + H 2 O =
N 2 O 5 + H 2 O =
CaO + HNO 3 =
NaOH + P 2 O 5 =
K 2 O + CO 2 =
Cu(OH) 2 = ? + ?
4. Осуществите превращения по схеме:
1) K → K 2 O → KOH → K 2 SO 4
2) S→SO 2 →H 2 SO 3 →Na 2 SO 3
3) P→P 2 O 5 →H 3 PO 4 →K 3 PO 4
|
Вы можете приобрести видеоурок (запись вебинара, 1,5 часа) и комплект теории по теме «Оксиды: получение и химические свойства». Стоимость материалов — 500 рублей. Оплата через систему Яндекс.Деньги (Visa, Mastercard, МИР, Maestro) по ссылке . Внимание! После оплаты необходимо прислать сообщение с пометкой «Оксиды» с указанием адреса электронной почты, на которую можно выслать ссылку для скачивания и просмотра вебинара. В течение суток после оплаты заказа и получения сообщения материалы вебинара поступят на вашу почту. Сообщение можно прислать одним из следующих способов:
Без сообщения мы не сможем идентифицировать платеж и отправить Вам материалы. |
Химические свойства основных оксидов
Подробно про оксиды, их классификацию и способы получения можно прочитать .
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H 2 O → Ca(OH) 2
CuO + H 2 O ≠
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота) .
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N 2 O 5 , NO 2 , SO 3 и т.д.).
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K 2 O + Al 2 O 3 → 2KAlO 2
CuO + Al 2 O 3 ≠ (реакция не идет, т.к. Cu(OH) 2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al 2 O 3 + H 2 O = H 2 Al 2 O 4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO 2 . Получается алюминат-ион AlO 2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие основных оксидов с восстановителями.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом .
Углерод (уголь) восстанавливает из оксидов только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C → Fe + CO

Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe 2 O 3 + CO → Al 2 O 3 + CO 2
CuO + CO → Cu + CO 2

4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H 2 → Cu + H 2 O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например , оксид цинка взаимодействует с алюминием:
3ZnO + 2Al → Al 2 O 3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например , цезий взрывается на воздухе .
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al → Al 2 O 3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + H 2 → Cu + H 2 O

4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH 3 → 3Cu + 3H 2 O + N 2
5. Взаимодействие основных оксидов с окислителями .
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O 2 → 2Fe 2 O 3
Современная энциклопедия
Оксиды - ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Иллюстрированный энциклопедический словарь
Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
Оксиды металлов - это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов. Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые… … Официальная терминология
оксиды - Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
ОКСИДЫ - хим. соединения элементов с кислородом (устаревшее название окислы); один из важнейших классов хим. веществ. О. образуются чаще всего при непосредственном окислении простых и сложных веществ. Напр. при окислении углеводородов образуются О.… … Большая политехническая энциклопедия
Основные факты
Основные факты - Нефть - это горючая жидкость, представляющая собой сложную смесь из углеводородов. Различные типы нефти существенно различаются по химическим и физическим свойствам: в природе она представлена и в виде черного битумного асфальта, и в форме… … Нефтегазовая микроэнциклопедия
Основные факты - Нефть - это горючая жидкость, представляющая собой сложную смесь из углеводородов. Различные типы нефти существенно различаются по химическим и физическим свойствам: в природе она представлена и в виде черного битумного асфальта, и в форме… … Нефтегазовая микроэнциклопедия
Оксиды - соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
Книги
- , Гусев Александр Иванович. Нестехиометрия, обусловленная наличием структурных вакансий, широко распространена в твердофазных соединениях и создает предпосылки для неупорядоченного или упорядоченного распределения…
- Нестехиометрия, беспорядок, ближний и дальний порядок в твердом теле , Гусев А.И.. Нестехиометрия, обусловленная наличием структурных вакансий, широко распространена в твердофазных соединениях и создает предпосылки для неупорядоченного или упорядоченного распределения…
Оксиды - это вещества, в которых молекулы состоят из атома кислорода со степенью окисления - 2 и атомов какого-либо второго элемента.
Оксиды образуются прямым путем при взаимодействии кислорода с другим веществом или косвенным путем - при разложении оснований, солей, кислот. Такой тип соединений очень распространен в природе, и может существовать в виде газа, жидкости или В земной коре также находятся оксиды. Так, песок, ржавчина, и даже привычная вода - это все
Бывают как солеобразующие, так и несолеобразующие оксиды. Солеобразующие в результате химической реакции дают соли. К ним относятся оксиды неметаллов и металлов, которые в реакции с водой образуют кислоту, а в реакции с основанием - соли, нормальные и кислые. К солеобразующим относится, например,
Соответственно, из несолеобразующих получить соль невозможно. В качестве примера можно привести оксид диазота и
Солеобразующие оксиды делятся, в свою очередь, на основные, кислотные и амфотерные. Поговорим подробней об основных.
Итак, основные оксиды - это оксиды некоторых металлов, соответствующие которым гидроксиды относятся к классу оснований. То есть при взаимодействии с кислотой такие вещества образуют воду и соль. Например, это К2О, СаО, MgO и пр. В обычных условиях основные оксиды представляют собой твердые кристаллические образования. Степень оксиления металлов в таких соединениях, как правило, не превышает +2 или редко +3.
Химические свойства основных оксидов
1. Реакция с кислотой
Именно в реакции с кислотой оксид проявляет свои основные свойства, поэтому подобным экспериментом можно доказать тип того или иного оксида. Если образовались соль и вода - значит, это основной оксид. Кислотные оксиды в подобном взаимодействии образуют кислоту. А амфотерные могут проявлять либо кислотные, либо основные свойства - это зависит от условий. Таковы основные отличия несолеобразующих оксидов между собой.
2. Реакция с водой
Во взаимодействие с водой вступают те оксиды, которые образованы металлами из электротехнического ряда напряжения, стоящими перед магнием. При реакции с водой они образуют растворимые основания. Это группа оксидов щелочноземельных и (оксид бария, оксид лития и пр.). Кислотные оксиды в воде образуют кислоту, а амфотерные на воду не реагируют.
3. Реакция с амфотерными и кислотными оксидами
Противоположные по своему химическому вступают в реакцию между собой, образуя при этом соли. Так, например, основные оксиды могут вступать во взаимодействие с кислотными, но не реагируют на других представителей своей группы. Наиболее активными являются оксиды щелочных металлов, щелочноземельных и магния. Даже в обычных условиях они сплавляются с твердыми амфотерными оксидами, с твердыми и газообразными кислотными. При реакции с кислотными оксидами они образуют соответствующие соли.
Но основные оксиды других металлов менее активны и практически не вступают в реакцию с оксидами газообразными (кислотными). Они только могут вступить в реакцию присоединения при сплавлении с твердыми кислотными оксидами.
4. Окислительно-восстановительные свойства
Оксиды активных щелочных металлов не проявляют выраженных восстановительных или окислительных свойств. И, напротив, оксиды не настолько активных металлов могут восстанавливаться углем, водородом, аммиаком или угарным газом.
Получение основных оксидов
1. Разложение гидроксидов: при нагревании нерастворимые основания разлагаются на воду и основной оксид.
2. Окисление металлов: щелочной металл при горении в кислороде образует пероксид, который потом при восстановлении образует основной оксид.